يشير مصطلح Bio-fumigation او التدخين الحيوي او التعقيم الحيوي للتربة الى طريقة او استراتيجية لمكافحة افات التربة والتي يستخدم فيها نباتات العائلة الصلبية Brassicaceae التي تحتوى انسجتها على نواتج ايض ثانوية عبارة عن مواد كبريتية عضوية تسمى لأGlucosinolates (GSL) والتي تتحرر وتنفرد عند تحطيم وتكسير انسجة هذه النباتات في التربة وتتحول وتتحلل مائيا في وجود الماء وانزيم Myrosinase الى مجموعة من المركبات من ضمنها مركبات isothiocyanate (ITCs) السامة للعديد من افات التربة كالفطريات والنيماتودا والحشائش ....الخ كما في الشكل التالي (Kirkegaard 2000 ).
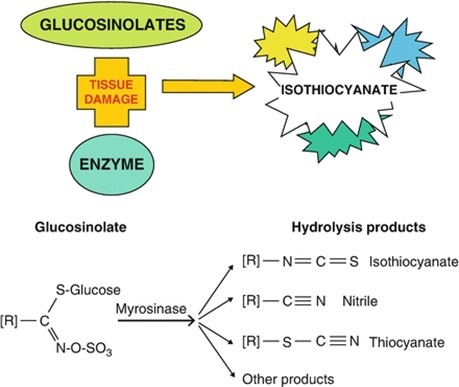
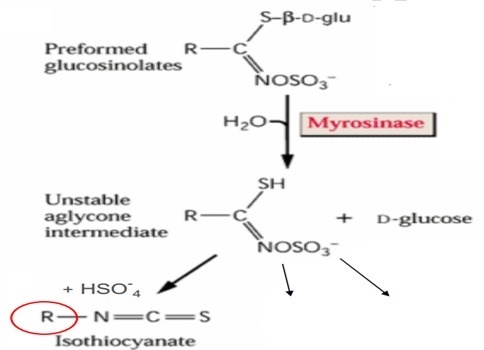
Figure 1: Glucosinolate
structure and products of hydrolysis (from Kirkegaard, 2009)
وتختلف نوع ITC الناتجة باختلاف مجموعة R المرتبطة بالمركب فيمكن ان تكون مجموعة اليفاتية فتسمى allyl او اروماتية arylعلى حسب نوع النبات ونوع ال glucosinolates (GSL) الذى ينتجها كمثال نبات الخردل البنى Brassica juncea ينتج GSL تسمى Sinigrin ينتج عن تحللها المائي نوع من الايزوسينات يسمى propenyl-ITC 2- وهكذا تختلف نوع ITC باختلاف النبات المستخدم فى عملية التعقيم كما يوضح الجدول (Potter et al., 2000).:
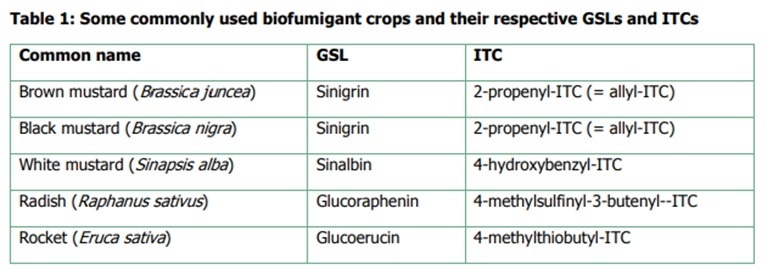
وبذلك تعتبر عملية ال Bio-fumigation هي البديل الحيوي والطبيعي لاستخدام التعقيم الكيميائي للتربة بواسطة مركب ميتام صوديوم والذى ييتحول أيضا في وجود الماء الى ,( methyl isothiocyanate (MITC. الغازية المعقمة للتربة.
- المحاصيل التي تستخدم في عملية التدخين الحيوي Bio-fumigation لمكافحة المسببات المرضة في التربة.
العديد من التقارير تناولت موضوع مكافحة المسببات المرضية للنبات الموجودة في التربة باستخدام عملية التدخين الحيوي biofumigation ومنها استخدمها في مكافحة بعض المسببات المرضية الهامة مثل فطريات الفيوزاريم والريزوكتونيا والبيثيم والفيتوفثرا والفرتسليوم والاسكلورشيم وبعض أنواع النيماتودا داخلية التطفل مثل نيماتوا تعقد الجذور و نيتماتودا الحويصلات والنصف داخلية كنيماتودا التقرح ونيماتودا الموالح.
بشكل عام الأبحاث المتعلقة بمكافحة افات التربة عن طريق التدخين الحيوي لم تأخذ حيزا تجريبيا كبيرا ومن ثم فقد تباينت نتائج عملية المكافحة تبعا لنوع الافة المستهدفة وتبعا لنوع الدراسات التي تركز على المشكلة الرئيسة المرتبطة باعتماد التدخين الحيوي بشكل تجاري.
طرق استخدام محاصيل التدخين الحيوي في مكافحة مسببات امراض التربة :
يمكن استخدام محاصيل التدخين الحيوي بطرق مختلفة منها:
1- خلط محصول التدخين الحيوي في التربة.
وهى الطريقة الأكثر شيوعا في عملية ال Bio-fumigation حيث يتم زراعة محصول التدخين والذى يحتوى على GSL كمحصول رئيسي . ولتحرير مستويات عالية من الايزوثوسينات ITCs من الانسجة النباتية يتم تمزيق وتحطيم هذه الانسجة فى وجود الماء المطلوب لضمان عملية التحلل المائي الانزيمية ثم بعد ذلك يتم خلطها وتقليبها جيدا فى التربة (Matthiessen & Kirkegaard, 2006; Kirkegaard, 2009). ثم بعد ذلك تتم عملية التغطية باستخدام بلاستيك شفاف او الملش لعدم تطاير غازITC وبالتالى تغلغله اكثر بين حبيبلت التربة واحداث مكافحة مثالية .

تعتمد زيادة كمية ITCs وكفاءة هذه الطريقة على عدة عوامل منها:
ا- اختيار أصناف نباتية تحتوى على كميات عالية من GSL
ب- زيادة تمزيق وتحطيم الانسجة والخلايا النباتية في وقت اجراء العملية.
ج-التأكد من وجود كميات مناسبة من الماء لتسهيل عملية التحلل المائي .
د- درجة الحرارة وذلك بالتغطية ببلاستيك شفاف لمده معينة.
2- استخدام مطحون بذور محصول التدخين مثل بذور الخردل .
حيث يتم استخدام مطحون بذور الخردل بعد نزع الدهون منها حيث تعتبر مصدر يحتوى على كميات كبيرة من GSL ومناسبا للتحلل المائي في وجود الانزيم لإنتاج ITCs بعد اضافتها للتربة. ومن ثم اظهر استخدام تلك الطريقة الواعدة نشاطا ضد المسببات المرضية فى التربة والى تشمل الريزوكتونيا ونيماتودا تعقد الجذور( Mazzola et al., 2007 & Lazzeri et al., 2009). اهم المميزات الرئسية لهذه الطريقة انه يمكن استخدام تلك المواد فى اي وقت من العام حتى فى الاوقات التى تكون فيها زراعة محاصيل التدخين غير متاحة(مثل الشتاء). يمكن دمجها بسهولة فى الدورات الزراعية, يمكن استخدامها فى الزراعات المحمية المكثفة .
3- طريقة المحاصيل الصائدة والتسميد الأخضر
توجد فوائد أخرى لاستخدام محاصيل التدخين الحيوي غير مكافحة المسببات المرضية مثل زيادة محتوى التربة من المادة العضوية وتحسين قوامها وتحللها الى العناصر الغذائية التي يحتاجها النبات والتي تزيد من نمو النبات وصحته. أيضا تستخدم بعض أنواع محاصيل Brassicaceae كنباتات صائدة للنيماتودا Jaffee et al., 1998)) .
4- التناوب في الدورات الزراعية والتحميل مع محاصيل التدخين الحيوي.
في هذه الحالة يتم حصاد الأجزاء الخضرية فوق سطح التربة وتعتمد مكافحة المسببات المرضية على GSL التي تفرز من الجذور . حيث أظهرت الدراسات اكتشاف مواد GSL و ITC المتسببة في مكافحة المسببات المرضية في منطقة انتشار الجذور وأيضا كشف وجود انزيمات myrosinase التي تساعد في إتمام التفاعل.
كيفية زيادة فاعلية وكفاءة مكافحة المسببات المرضية عن طريق ITC الناتجة من التدخين الحيوي:
1- عمل علاقة بين مستويات وتركيزات كل من مواد GSL و ITC نسبة المكافحة للمسببات المرضية.
2- تحديد نبات التدخين الحيوي المناسب .
3- تحسين عملية الزراعة والتكثيف النباتي وتعظيم إنتاجية محصول التدخين الحيوي وذلك بمعرفة معدل التقاوي الأمثل ووقت الزراعة المناسب ومعاملات التسميد والري المناسبة.
4- كفاءة وزيادة تحطيم الانسجة النباتية والخلط الجيد في التربة واضافة الماء لزيادة كمية ITCs المتحررة وبالتالي زيادة نتائج المكافحة.
التحديات المستقبلية في هذا الاتجاه:
من وقت اطلاق مصطلح ال Biofumigation منذ اكثر من عقدين من الزمان ولاتزال هناك حاجة للمزيد من الأبحاث لاستخدام هذا الاتجاه من المكافحة بشكل أوسع وعلى نطاق تجاري خاصة مع تزايد الاتجاه العالمي للتقليل من استخدام الكيمياويات والمبيدات في مكافحة المسببات المرضية في التربة. وذلك بإصدار تشريعات من الاتحاد الأوربي تحد من استخدام المبيدات والاتجاه نحو برامج المكافحة المتكاملة والبدائل الأمنه على الانسان والبيئة ومن هذا المنطلق اصبح الاتجاه العام مهيئا لتجديد الاهتمام والمبادرات للتمويل هذا المجال.
المراجع References :
Jaffee BA, Ferris H, Scow KM, 1998. Nematode-trapping fungi in organic and conventional cropping systems. Phytopathology 88, 344-50.
Kirkegaard J, 2009. Biofumigation for plant disease control – from the fundamentals to the farming system. In: Disease Control in Crops. Wiley-Blackwell, 172-95. Kirkegaard J, Matthiessen J, (2004). Developing and refining the biofumigation concept. Agroindustria 3, 233-239.
Kirkegaard JA, Gardner PA, Desmarchelier JM, Angus JF, 1993. Biofumigation - using Brassica species to control pests and diseases in horticulture and agriculture. In: Proceedings of the 9th Australian Research Assembly on Brassicas pp 77-8. N. Wratten and RJ Mailer eds.
Kirkegaard, J. (2000). Evaluating biofumigation for soilborne disease management in tropical vegetable production. Australian Centre for International Agricultural Research . Project no. SMCN/2000/114.
Lazzeri L, Curto G, Dallavalle E, D'avino L, Malaguti L, Santi R, Patalano G, 2009. Nematicidal efficacy of biofumigation by defatted Brassicaceae meal for control of Meloidogyne incognita (Kofoid et White) Chitw. on a full field zucchini crop. Journal of Sustainable Agriculture 33, 349-58.
Matthiessen JN, Kirkegaard JA, 2006. Biofumigation and enhanced biodegradation: opportunity and challenge in soilborne pest and disease management. Critical Reviews in Plant Sciences 25, 235-65.
Mazzola M, Brown J, Izzo AD, Cohen MF 2007. Mechanism of action and efficacy of seed meal-induced pathogen suppression differ in a Brassicaceae species and time-dependent manner. Phytopathology 97,454-460.
Potter M, Vanstone V, Davies K, Rathjen A, 2000. Breeding to increase the concentration of 2-phenylethyl glucosinolate in the roots of Brassica napus. Journal of Chemical Ecology 26, 1811-20.






